檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
全部
我們緻力于細胞增殖、分化,以及個體發育過程中細胞結構與功能的動态變化及其調控機制等方面的研究。特别關注細胞骨架對細胞極性化形态結構以及生命活動過程的組織作用;神經系統的發育與細胞分化;細胞内膜系統的動态行為與信号轉導、腫瘤細胞的增殖、細胞自噬和細胞凋亡等的關系。
我們的研究集中于幹細胞與轉化醫學中的RNA生物學。
在幹細胞研究方面,實驗室最近的研究通過對于剪接體(splicesoeme)的抑制,實現了迄今為止分化潛能最高的人類和小鼠的全能性胚胎幹細胞的捕獲和培養 (Cell, 2021; Cell, 2024)。在此基礎上,我們将進一步對該培養條件進行優化,以期最終獲得不同物種來源的全能性幹細胞的體外培養。繼而全能性幹細胞為起始細胞,探索其分化到不同種類的功能細胞及類器官的分化體系,并進行動物個體的從頭合成和重構,從而最終獲得可應用于再生醫學的高質量細胞和器官。
實驗室也利用基礎的生物化學和分子生物學的手段鑒定和發現新型的RNA調控通路。實驗室最新的研究發現了一種通過基因轉錄起始事件介導的的微小RNA(microRNA)的整體劑量調控機制,以及該機制在早期胚胎發育三胚層命運決定中的關鍵作用 (Nature, 2021)。未來我們繼續緻力于發現和鑒定決定細胞分化命運及腫瘤發生過程中的核心RNA介導的調控通路,并解析其生理學功能。
我們在嘗試利用已知相關知識進行跨物種基因工程應用的相關研究。比如我們最近利用一種植物特異免疫蛋白RDR,實現了對于腫瘤細胞中有缺陷的miRNA的特異編輯和修複,恢複了miRNA對于腫瘤細胞增值的廣譜抑制,開發了腫瘤治療的新方案 (Cell, 2022)。
最後我們也廣泛利用單細胞轉錄組及空間轉錄組等高通量測序技術,解析早期胚胎發育過程及兒童腫瘤發生過程中發育及腫瘤微環境的建立及穩态維持,并試圖找到決定早期胚胎發育及疾病發生過程的決定的關鍵環境因子及事件(Cell Stem Cell, 2022; Cell, 2023a; Cell, 2023b)。
實驗室圍繞着生命科學的核心内容,主要運用冷凍電鏡技術研究與重大生命過程相關的分子機器的結構和功能,探索重要的基礎生物學機制問題及相關的人類重大疾病的發生機制。近年來,實驗室的科研工作聚焦于核酸-蛋白複合物分子機器及組成複雜的大型蛋白複合物。實驗室的重要研究領域包括:
(1)病原體的核糖體是很多抗菌藥物的天然靶點,同時人源核糖體生物生成(ribosome biogenesis)也在多種人類腫瘤細胞中異常上調,并且和腫瘤轉移的能力正相關。實驗室以細菌、酵母、人源細胞系作為模型,研究人類病原體、模式生物以及人類核糖體的生物組裝機制,不同核糖體結合蛋白在蛋白翻譯中的新穎調控功能和分子機制,以及潛在藥物靶标的發現;
(2)DNA複制是分子生物學的核心環節,DNA複制的紊亂也是衆多腫瘤的一項标志性特征。實驗室研究真核生物DNA複制起始過程的蛋白質分子機器的結構和工作機制。
(3)實驗室同時也和衆多課題組緊密合作,包括臨床科學家,研究人類重大疾病治療靶點的結構和機制。
我們是原位結構生物學實驗室。關注“細胞建築學”:各個亞細胞結構是如何搭建成一個具有完整生物學功能的細胞,以及“生物大分子社會學”:細胞内的細胞器、生物大分子之間的相互關系。
原位結構生物學是基于冷凍光電聯用(CLEM)、冷凍電子斷層掃描(cryo-ET)等技術的新興結構生物學分支,是一種可以在細胞生理狀态下,對生物大分子和亞細胞結構在分子分辨率(1 ~ 10 nm)水平進行原位的結構分析和功能研究的技術手段。我們主要研究方向包括:
細胞是生物體的基本單元,每個細胞都是一個複雜而精密的生态系統,在内外環境中都有着精心維護的平衡。細胞内部有着複雜的亞細胞結構,細胞核作為遺傳物質的容器,其染色質環境同樣複雜,包括染色質的多級複雜結構和表觀遺傳信息。而在細胞外部,細胞間的相互作用是生物系統維系的關鍵。雖然以免疫系統和神經系統為研究對象,對細胞之間的信号與功能進行了比較充分的研究,但目前我們所知道的隻是其中的冰山一角。在免疫系統中,存在一類特異性超高的分子──淋巴細胞B和T細胞表面的受體,也即我們熟悉的B細胞受體和T細胞受體,前者的分泌形式即抗體。随着研究技術的快速發展和科學數據的不斷積累,研究的焦點将逐漸從低等模式生物逐漸轉移到人本身,而研究的層次也将更趨于系統性和整體性。我們實驗室将以小鼠和人的免疫細胞為主要研究對象,研究方向集中在:
1. 在哺乳動物複雜的染色質環境下研究DNA複制、DNA損傷和DNA代謝與基因組穩定性和腫瘤發生之間的關系;
2. 在時間和空間尺度上研究衰老過程或不同組織中淋巴細胞功能的變化以及相關的DNA代謝變化;
3. 深入挖掘抗體的發育和成熟機理,并利用合成生物學技術改造細胞,促使其實現抗體生産和抗體進化。
主要研究方向:
1、 蛋白質組學新技術新方法-蛋白質高可信度鑒定、定量及翻譯後修飾位點的質譜鑒定
2、 腫瘤細胞表面新生抗原和免疫多肽組的大規模鑒定及其在腫瘤發生、發展與轉移中的作用機制
3、 基于腫瘤細胞表面新生抗原的特異性抗體、抗體藥物偶聯物、免疫多肽組的制備與體内作用機制
4、 神經系統退行性病變相關蛋白與小膠質細胞激活的調控作用機制
主要研究進展:
實驗室主要利用生物質譜技術大規模鑒定與發現重大疾病發生發展相關蛋白及其動态變化,特别關注蛋白質翻譯後修飾(單磷酸化及多磷酸化、乙酰化、甲基化、泛素化、糖基化、組蛋白組合修飾等)對其生物學功能的影響。針對神經系統退行性病變中小膠質細胞激活、Aβ清除與降解、神經元死亡、腫瘤細胞表面新生抗原、免疫細胞和腫瘤微環境相關巨噬細胞表面等發現并鑒定關鍵蛋白及其修飾變化,發現新的關鍵靶标和标志物;結合分子生物學、生物化學、細胞生物學和蛋白質組學技術等多重手段,利用細胞與動物模型和臨床人類标本分析,對腫瘤細胞表面特異蛋白和基因融合蛋白進行體内外功能研究,同時制備特異性抗體、多肽和抗體藥物偶聯物,闡明藥物體内調控機制。此外,我們還開展了蛋白質與抗體藥物等電點、純度、全序列、二硫鍵、糖基化、氧化等修飾的質譜分析研究,建立蛋白藥物相關質量标準。近期主要開展了Cdk5和Sds3調控小膠質細胞激活調控神經系統炎症,以及外泌體臨床檢測新型标志物、結直腸癌和乳腺癌腫瘤細胞表面蛋白新靶标的大規模篩選與功能研究。
研究領域:“感染-免疫-腫瘤”及其相關的細胞信号轉導
識别細胞内DNA的cGAS-STING通路對抗感染和抗腫瘤的免疫監視及治療至關重要。蔣争凡實驗室是發現STING蛋白重要功能的三個實驗室之一(命名為ERIS,PNAS, 2009)及其二聚化(寡聚化)的重要作用,并對其進行了深入系統的研究:發現轉錄因子NFkB和STAT6對該通路介導的免疫反應非常重要(JI, 2017a;Cell, 2011);硫酸化糖胺聚糖是STING活化必需的第二類配體及其高爾基體轉運的原因(Immunity, 2021);ARMH3-PI4KB合成的PI4P驅動STING的内體轉運并維持活化(Immunity, 2023);STING通過形成“相分離器”調節天然免疫(Nature Cell Biology, 2021);Caspases負調控天然免疫反應,包括炎症小體活化的Caspases(Immunity, 2017;JI, 2017b)及凋亡活化的Caspases(Molecular Cell, 2019),避免過度免疫反應并保證細胞凋亡“免疫沉默”;錳離子對于機體抗感染重要(Immunity, 2018;PNAS, 2021),Mn2+是細胞内cGAS的第二個激活劑,以獨特方式激活cGAS(Cell Reports, 2020),以此為基礎發明了可激活細胞免疫、體液免疫和黏膜免疫的錳佐劑(CMI, 2021)及增強腫瘤免疫治療的“錳免療法”(Cell Research, 2020);發現3`3`-cGAMP特異性磷酸二酯酶(Cell Research, 2015)。此外,發現PCBPs-AIP4介導的蛋白質降解途徑負調控天然免疫關鍵分子MAVS降低或避免RNA病毒感染引發的過度反應(Nature Immunology, 2009; Cell Research, 2012)以及NEMO-IKKα/β對于RIG-I-MAVS通路中激活TBK1/IKKε至關重要(PLoS Pathogens, 2017)。
以昆蟲為傳毒介體的病毒病害一直是造成水稻産量損失最嚴重的病毒病害之一。水稻矮縮病毒 (Rice dwarf virus, RDV) 和水稻條紋葉枯病毒 (Rice stripe virus, RSV)是對我國水稻産生過嚴重産量損失的病毒病害。RDV由葉蟬以持久增殖型方式傳播, RSV由灰飛虱以持久方式傳播,且可經卵傳播。迄今,對病毒如何引起病害研究很多,但是,病毒與介體傳毒昆蟲的相互作用研究的很少。本實驗室主要研究方向:1)病毒與植物宿主的相互作用以及病毒侵染對宿主發育的影響和緻病機制;2)植物宿主對病毒的防禦機制與病毒的反防禦機制;3)病毒與傳播介體昆蟲宿主的相互作用以及介體傳播病毒機制;4)病毒對昆蟲介體免疫系統的幹擾和介體的抗病毒免疫機制。
你是否想要近距離接觸來自海底的神秘智慧生物,觀察它們炫目的變色能力和繁複的觸手運動,運用前沿的神經科學與人工智能技術窺探它們的内心世界?加入我們吧!我們研究頭足類動物(包括烏賊和章魚)的行為與神經。
頭足類動物擁有無脊椎動物中最複雜的神經系統。他們的腦比很多與之體型相當的哺乳動物都還要大(神經元數量比小鼠多一個數量級),也表現出很多複雜的行為和高級的認知功能:如模仿學習,工具使用,有顯著個性等。在演化曆程上,頭足類和我們在6億年前就已經分開了。我們的共同祖先才剛剛演化出神經元,還沒有聚集成可稱之為‘腦’的中樞神經系統。頭足類與脊椎動物各自沿着不同的路徑獨立演化。頭足類神經系統是動物界裡采取和人腦不同的發展路徑所能到達的智力巅峰。研究頭足類另類的智能,既可以發現趨同演化的神經機制,将會揭示在神經計算層面的普遍規律;也可研究人類所不具備的獨特技能背後的神經機制:比如變色僞裝的能力和複雜的觸手運動控制。
(1)烏賊變色僞裝行為的神經機制
烏賊可以改變全身的顔色和圖案來模拟環境并隐藏其中。研究其變色行為有兩個重要意義:一、烏賊的皮膚像一個覆蓋全身的顯示器,通過神經-肌肉系統實時并行控制上百萬個色素細胞的大小來組成不同的圖案,可從該系統中發現控制超高維度的運動輸出的複雜神經算法。二、可以通過烏賊體表圖案的實時變化讀取動物的主觀視知覺和內隐狀态;且由于變色僞裝可以瞞過包括人類在内的捕食者,研究此系統亦可揭示人類視知覺區别物體與背景的原理。研究烏賊控制變色僞裝的神經環路與算法将有助于啟發和革新人工智能的諸多領域。此外,随近年來衛星與無人機偵察技術的發展,軍事單位的迷彩與僞裝也亟需來自動物僞裝策略的仿生學借鑒。
(2)章魚複雜觸手運動的分布式控制
去中心化的系統由大量分布式的控制節點組成,相比于集中式的控制系統,往往能兼具更好的穩定性和更好的靈活性。頭足類神經系統很大程度上是一個去中心化的控制系統,超過2/3的神經元分布于外周,相比之下人類隻有1%的神經元分布于外周。因此,頭足類動物外周神經系統是研究行為分布式控制的獨特對象。
章魚的觸手運動十分複雜,可以用以操縱複雜的工具。它的觸手可以在任意地方朝任意方向彎曲,也可以在任意地方伸長、縮短、變軟、變硬。相比于人類四肢運動的自由度受限與關節的數目,而章魚的觸手幾乎有着無限的自由度。章魚采取一種分布式的方式進行這種超高維度的運動控制,有超過60%的神經元分布于觸手上;在切斷中樞控制之後,觸手自身的神經網絡也能産生協調而複雜的運動。研究章魚觸手運動的分布式控制,将為仿生軟體機器人系統提供獨特的運動控制理論,也将有助于設計出更好的具自适應能力的神經仿生義肢。
神經科學的核心目标是闡明感知、行為和意識等産生的神經機制。
利用果蠅、小鼠和非人靈長類等多種模式動物,我們研究以上過程:1) 視覺“暗光”的分子機制 (Science, 2011; Nature Neuroscience,2008; Current Biology, 2020); 2) 嗅覺編碼機制 (PNAS, 2016; Nature Communications, 2017); 3) 機械感知對進食決策的調控 (Science Advances, 2019); 4) 生物鐘的神經機制 (Nature Communications, 2018; Science Advances, 2022; Nature 2023)。
我們發展了國際前沿的神經電生理技術(包括活體動物腦的多電極膜片鉗記錄),結合分子遺傳、光遺傳和雙光子鈣成像等,揭示大腦産生感知和行為的基本規律。目前,正在進行的研究課題包括:(1) 感覺信号編碼和加工的神經機制;(2) 進食等本能行為的神經機制; (3) 生物鐘和睡眠的神經機制。
基因組多樣性和演化實驗室成立于2009年,以貓科動物基因組學和保護生物學研究為核心,具備分子生物學和生物信息學幹濕實驗綜合實力。實驗室建有生物樣品庫及數據庫管理系統、古DNA超淨平台、基因組數據處理計算服務器等硬件設施;在高通量數據分析、動物基因組組裝與注釋、群體基因學、基因與性狀關聯性分析、連鎖遺傳定位等有豐富的數據分析經驗;且能有效開展分子生物學、生化和細胞水平的功能實驗。
我們課題組緻力于探索腦發育中細胞命運決定和細胞命運記憶傳承的分子調控機理及相關神經發育疾病的發生與防治。
腦發育中的細胞命運記憶 – 有絲分裂書簽
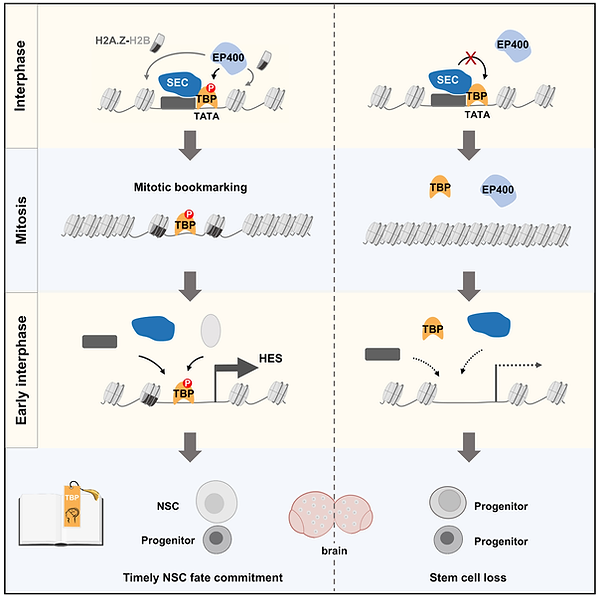
如何記住?- 有絲分裂書簽TBP維持神經幹細胞命運記憶
細胞的命運和身份主要由其獨特的基因調控網絡決定和維持。細胞命運決定或維持過程出現錯誤均可能導緻疾病發生。然而,有絲分裂卻給細胞命運或身份的跨代繼承帶來了巨大挑戰。細胞在進入有絲分裂後,染色質高度凝集成染色體,絕大多數構成基因調控網絡的元件從染色體上剝離或降解,轉錄活動幾乎完全停滞。随着其獨特基因調控網絡在有絲分裂期的“分崩離析”,細胞好似進入短暫失憶狀态。那麼,細胞在退出有絲分裂進入分裂間期時,是如何精确、及時地重建其獨特的基因調控網絡的呢?關乎細胞命運或身份的“記憶”在有絲分裂期如何被精确儲存,在分裂間期又如何被及時喚醒呢?
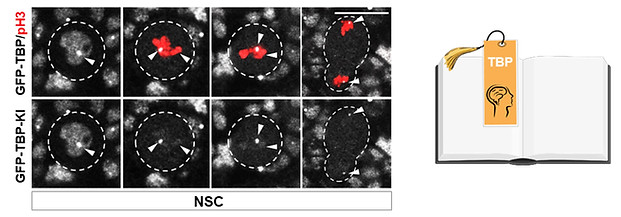
我們的最新研究發現在神經發育過程中,轉錄因子TBP通過招募染色質重塑因子EP400增加局部染色質可及性,作為有絲分裂書簽保留在神經幹細胞染色體上,進而維持神經幹細胞的命運記憶。這項研究發現書簽蛋白的有絲分裂保留促進神經幹細胞自我複制和增殖,首次揭示了有絲分裂書簽對神經發育的重要生理學意義,并闡明了書簽蛋白通過調控局部染色質可及性實現染色體保留的新機制。值得一提的是,該研究建立了一個全新的技術方案,實現對發育腦中書簽蛋白在染色體上的保留位點的精确鑒定。這一新方法将助力有絲分裂書簽在其它物種和其它組織器官中的發現及其生理學功能和機制研究的開展。這一研究成果于2024年12月發表于國際知名學術期刊 Molecular Cell。
原文鍊接: http://doi.org/10.1016/j.molcel.2024.11.019
簡介: https://mp.weixin.qq.com/s/VftxDuaIhvym1ybTzn7Hlg
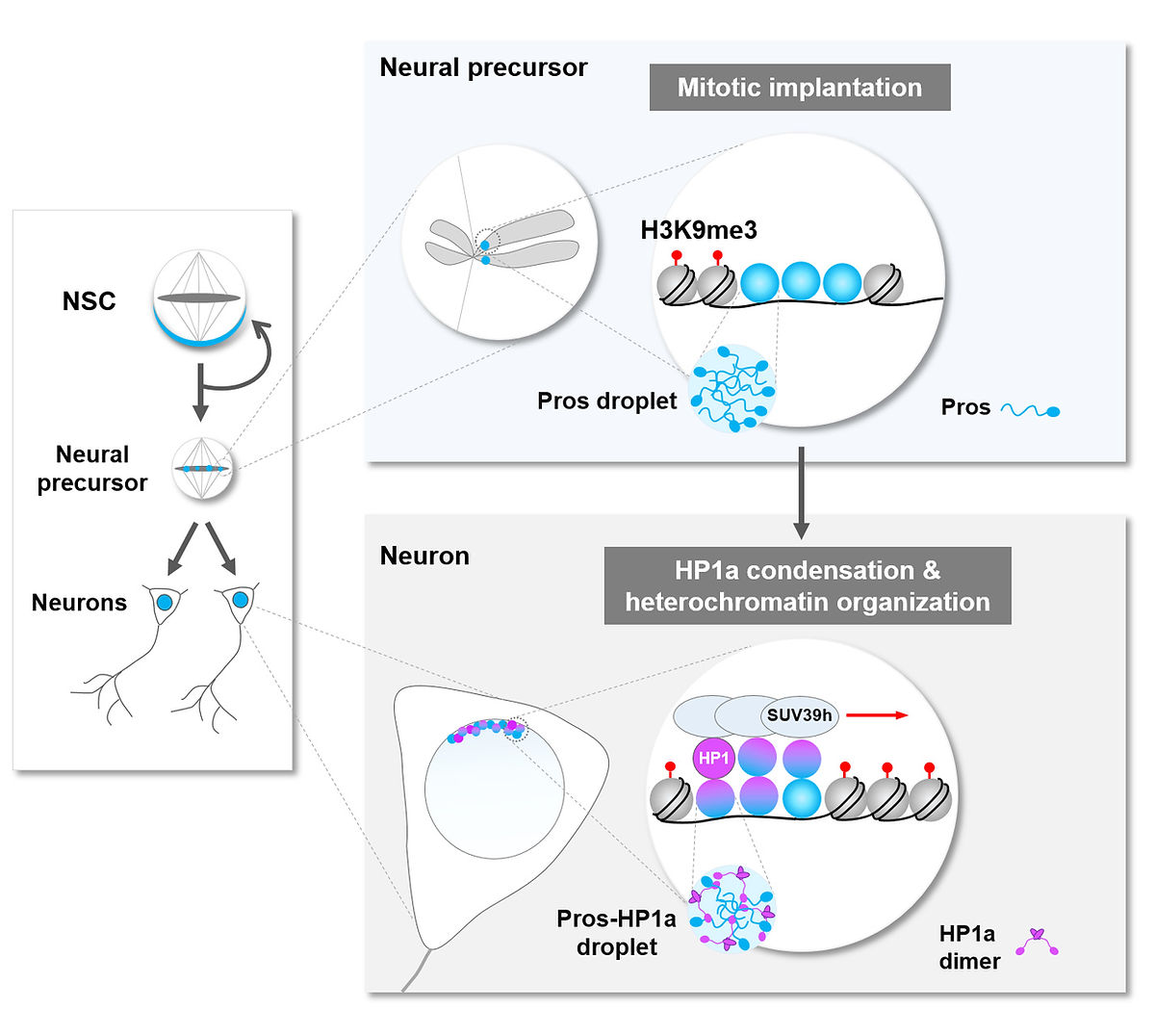
如何遺忘?- 植入染色體的Prospero 轉錄因子凝聚體驅使神經元終末分化
異染色質區域在細胞終末分化過程中如何凝聚和擴展一直以來都是懸而未決的重要科學問題。我們近期的研究發現一個在進化上高度保守的轉錄因子Prospero通過液-液相分離得以植入神經前體細胞有絲分裂染色體的異染色質區域,進而通過促進異染色質區的凝聚和擴展形成轉錄抑制環境,永久沉默自我複制相關基因的表達,最終确保神經元終末分化命運的鎖定。這項研究出乎意料的結果揭示了轉錄因子通過其生物物理特性的變化引起異染色質結構重塑,進而驅動細胞終末分化的新機制。同時,這項研究首次建立了轉錄因子的液-液相變與生理條件下一系列重要生物學事件之間的因果關系,為相分離在動物發育過程中的重要生理學意義提控了強有力的證據。作為亮點推薦文章(featured article) , 這一研究成果于2020年2月發表于國際知名學術期刊 Developmental Cell。雜志同期還配發了評述文章和亮點推薦。
原文鍊接:https://www.cell.com/developmental-cell/pdf/S1534-5807(19)30990-6.pdf
簡介:http:/homes/Index/news_cont/22/14899.html
腦發育中的細胞命運鎖定與疾病發生
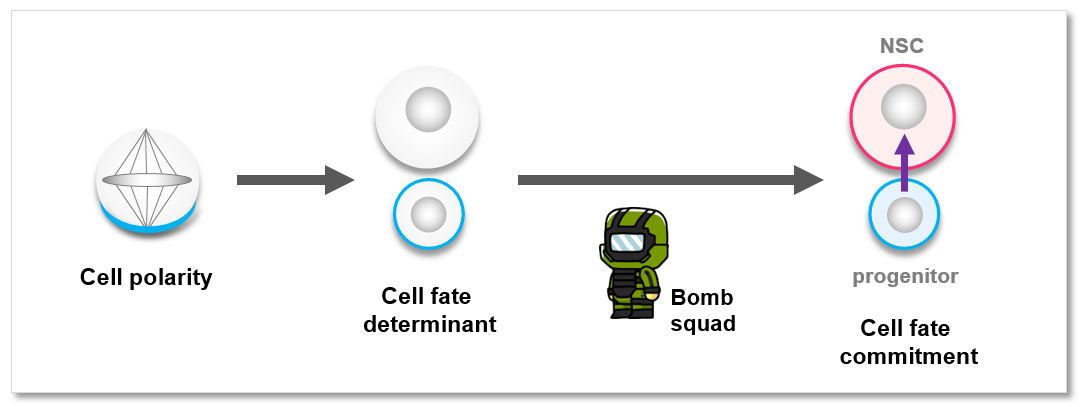
神經幹細胞命運及時鎖定 - 信号放大器
幹細胞自我更新與分化間精妙平衡的打破會引起組織穩态失衡,進而導緻發育缺陷和癌症發生。我們的研究發現由神經幹細胞不對稱分裂最初建立的子細胞間的微小差異需要經過一個快速放大的階段才能被最終鎖定為兩個截然不同的子細胞命運,并揭示超級延伸複合物 SEC 通過“信号放大器”機制,驅動這一放大過程快速、精确、穩健地完成。這項研究所揭示的細胞内放大器機制代表了一種細胞自主調控不對稱分裂後子細胞命運鎖定過程精确性與穩健性的普适規律。此外,該研究也為超級延伸複合體的過度激活與多種人類癌症的相關性提供了全新的理論解釋。該研究發現于2017年3月作為封面文章 (cover article) 發表于發育生物學領域頂級期刊Developmental Cell。雜志同期還配發了評述文章和亮點推薦。
原文鍊接:https://www.cell.com/developmental-cell/pdf/S1534-5807(17)30118-1.pdf
簡介:http:/homes/Index/news_cont/22/4151.html

神經祖細胞命運及時鎖定與腦腫瘤發生
我們的研究發現 Retromer 複合體作為“拆彈部隊”将神經祖細胞内可能被“引爆”的 Notch 受體及時“拆除”并運離,從而确保神經祖細胞命運的及時鎖定。該研究揭示的由 Retromer 複合體介導的保護機制可能代表了一種普适規律:通過該機制,潛在有害或有毒的蛋白受體可以被及時清除,從而避免不良的後果。該研究也為解析 Retromer 複合體失活與多種人類癌症相關性的分子機制提供了重要線索。該研究發現于2018年9月發表于eLife 雜志,獲得了同期雜志的特别新聞推送。
原文鍊接:https://elifesciences.org/articles/38181
簡介:http:/homes/Index/news_cont/22/4039.html
視覺是高等動物最重要的感知通道,人類獲取的信息80%以上來自視覺。視覺認知神經機制研究對于理解大腦智能的奧秘,構建類腦計算、實現人工智能技術突破,均有重要科學意義。視覺系統的複雜性,源于視覺皮層神經環路的複雜性。由于技術的限制,我們對人類視覺系統環路機制的了解仍然非常有限。
精确到單個神經元的神經環路解析,将能提供腦皮層神經元編碼功能及其相互間的連接和計算關系,這是系統神經科學家長久以來的夢想,也是實現類腦計算、突破人工智能的關鍵和基礎。近幾年,随着在體雙光子成像、光遺傳等新技術湧現,使得這一夢想有可能成為現實,2015年,美國腦計劃斥資1億美元,啟動首個專項腦皮層網絡計劃(MICrONS),使得精細的神經線路繪制成為腦科學競争新的至高點。
我們實驗室建立了首個清醒猴雙光子成像系統,能以單細胞分辨率檢測大量神經元對視覺刺激的反應,分析其視覺信息編碼。該項技術,可以應用在各個不同腦區,包括初級到高級視皮層、前額葉等,以及各種腦認知功能研究,比如客體識别、選擇性注意、工作記憶等的神經機制研究。雙子顯微鏡還可以進行高分辨率的樹突成像,獲得目标神經元在視覺信息處理中的輸入輸出和計算關系。利用樹突成像、光遺傳等新技術,可以獲得單個神經元的局部神經線路,并繪制猕猴視覺皮層的精細神經線路,最終理解腦認知信息處理基本原理,并為類腦計算及新一代人工智能研究提供有突破性的概念和生物學基礎。
主要的研究方向在于運用數學和大規模科學計算的方法去模拟、數值仿真、分析神經生物學中神經元網絡的動力學特性,通過數學分析了解哺乳動物皮層的生物功能是如何在神經元網絡各組分之間的相互作用中産生的。在神經生物學領域中最有意義的貢獻是揭示了神經元網絡動力學和網絡結構之間的可能聯系,而此聯系已有神經生理學上的實驗證據。并且通過模拟哺乳動物視皮層的大規模神經元網絡,利用數學方法找到了一個可能的分岔結構确定了一個視皮層動力學上的運行點,從而發現了哺乳動物視覺朝向選擇性的一個新機制。回國之後,課題組已經 (1) 利用數據時空分解方法研究大規模神經元網絡的動力學性質并進行數據驅動式降維; (2) 應用數學降維方法,開拓分析光學成像數據的技術,發展預測神經元功能網絡和功能連通性(functional connectivity)的算法,(3) 開展同時具有高空間分辨率和高時間分辨率的光學成像技術,研發線蟲行為及其神經環路同步成像的光學成像系統。
本實驗室招收對如下課題感興趣的本科生、博士生和博士後(請随時聯系:wsq@pku.edu.cn):
1. 鈣通道和通道型鈣信号蛋白的電生理學
2. 鈣信号轉導相關蛋白的冷凍電鏡結構生物學
3. 細胞局部鈣信号(鈣火花、鈣火星)的時空動态和分子機制
4. 細胞鈣穩态和鈣信号轉導的轉錄調控機制
5. 細胞鈣紊亂及心髒疾病的分子機制和早期幹預對策
6. 自主神經系統對心肌細胞鈣穩态和鈣信号轉導的調控
7. 心髒及其神經支配的發育、再生和類器官模拟
8. 冬眠動物細胞鈣穩态和代謝調控機制及冬眠的人工誘導
實驗室緻力于RNA/DNA修飾的新生物學通路、新功能和新機制研究以及基因編輯新方法的開發。我們綜合運用包括化學生物學、表觀遺傳學、RNA修飾、基因編輯、單細胞組和基因組學等多學科手段,尤其關注RNA生物學在人類疾病診斷與治療當中的應用。

實驗室關注動物的行為,目前,我們最感興趣的是反應時間,抑制控制(如等待),時間感知(如運動計時)和物體識别。以大鼠為行為模式,通過訓練動物執行相關任務來了解這些行為形成和輸出的神經機制,包括對學習過程的了解,以及學習後神經活動與行為的關系。我們用大量的精力通過損傷,化學遺傳學和光遺傳學的方法來幹擾指定腦區,并研究這種操作對動物行為的影響,其中,會通過統計學和機器學習進行詳細姿态分析。為了解神經元在行為中的功能,我們主要采用慢性多通道電生理記錄,同時監測幾十甚至上百個神經元的放電活動,并結合高頻錄像解析神經元與肢體活動的精細關系。長遠看來,通過對腦基本功能的機制解析,實驗室或許能幫助人們進一步理解導緻認知或運動障礙的神經系統疾病,如帕金森氏症,沖動,和多動症。
古代基因組學是利用考古或古生物樣本中獲取的遺傳信息,研究其遺傳背景和種群曆史的技術。本實驗室的研究方向為人和動物的古代基因組學,緻力于探究東亞地區人群遺傳背景的曆史變遷、與歐亞大陸不同地區人群之間的遺傳交流;以及家養動物的起源、擴散、和這些與人類存在密切聯系的動物所反映的人類群體曆史。
以斑馬魚(Danio rerio)為模式動物,開發并完善以CRISPR/Cas為基礎的基因組編輯技術,結合單細胞測序等技術,研究心血管、胰腺等組織器官發育與再生的遺傳基礎及其基因表達調控機制,建立人類疾病的斑馬魚模型并進行發病機制研究。
I. 本實驗室長期以來主要以細胞生物學、分子生物學和生物化學等為研究手段,在分子水平、細胞和亞細胞水平以及組織和個體水平上,從事幹細胞增殖與分化、細胞周期調控、細胞核結構和動态變化及功能、Ran GTP酶功能調控等方面的研究。實驗材料主要包括:培養細胞,小鼠,非洲爪蟾,果蠅等。
II. 已取得如下主要成績:
1,發現Ran GTPase 控制核膜裝配(Science, 2000; Curr Biol, 2011; J Cell Sc, 2012)。10,發現Aurora A/B, Plk1, Cdk1等激酶綜合調控紡錘體裝配(PNAS,2009,2013;Cell Res, 2008, 2011; J Cell Sci, 2009, 2013a, 2013b)。
11,發現CDK1, Aurora A/B和TPX2等綜合調控紡錘體裝配的新機制(J Cell Biol, 2015a; J Cell Sci, 2015;J Biol Chem, 2015)。
12, 發現去泛素化酶Ups16和Plk1綜合調控動粒與紡錘體微管的結合及紡錘體裝配的調控機制(J Cell Biol,2015b;CMLS,2017)。
13,發現細胞周期調控因子調控初級纖毛動态變化及其細胞信号轉導功能(J Cell Sci, 2013, 2014;PLoS Biol, 2015; J Biol Chem, 2017a)。
14,發現DNA複制起始調控因子CDC6調控rDNA轉錄的新機制(J Cell SCI,2016)和調控中心體複制的新機制(NatureCommunications,2017)。
15,發現CDK4-Cyclin D1激酶調控細胞周期起始的新機制(J Biol Chem,2017b)。
III. 在研經費主要來源:科技部幹細胞專項;科技部蛋白質機器專項;基金委重點課題;基金委重大國際合作等。
IV. 熱烈歡迎有志從事相關基礎研究的優秀博士後、博士研究生和本科生加盟。
本實驗室的研究集中在探讨阿爾茨海默病等神經退行性疾病中細胞死亡的機制。我們發現了胞内澱粉樣沉積具有毒性并且在阿爾茨海默病早期引起神經元死亡。另外,我們還發現了一種細胞和細胞之間的稱為納米連接的結構,納米連接可以将細胞聯體并轉運包括澱粉樣沉積在内的胞内物質。納米連接可能在神經退行性疾病中傳遞細胞死亡信号并且造成細胞級聯性死亡。在另一方面,我們發現在阿爾茨海默病的動物中,軸突和軸突起始節部位的可塑性産生改變。在将來的研究中,我們将繼續探讨這種可塑性改變的機制和其對阿爾茨海默病的發生的影響。
張澤民實驗室緻力于用前沿的基因組學和生物信息學技術來解決癌症生物學中的重要問題,利用計算和實驗相結合方法來揭示腫瘤發生過程、腫瘤微環境和對藥物響應中的系統變化和重要遺傳因素,以推進癌症免疫治療和靶向治療的發展。主要的研究方向包括:一,應用單細胞測序技術來研究腫瘤微環境特别是腫瘤浸潤免疫細胞的精确組成、相互作用、以及功能狀态;二,研究腫瘤的異質性、基因組機制、及其對耐藥性的影響;三,開發原創的生物信息學工具和數據庫,來進行單細胞基因組數據和癌症基因組大數據的整合、分析和可視化,以揭示癌症的亞型、驅動基因以及其他緻癌因素的遺傳基礎,從而發現新型癌症靶點和标記物。
主要研究方向包括鑒定影響腫瘤發生發展和轉移調控的新蛋白,揭示泛素化、類泛素化、乙酰化等蛋白質翻譯後修飾在DNA損傷應答、腫瘤細胞耐藥、腫瘤代謝、免疫調控中的作用和分子機制。先後主持和承擔了國家自然科學基金生命學部和醫學部重點項目(3)、面上項目(7),國際合作ICGEB課題(2),教育部博士點優先發展基金、科技部863、973、國家重大科學研究計劃近二十個項目的研究。
全部
B
C
D
我們的研究集中于幹細胞與轉化醫學中的RNA生物學。
在幹細胞研究方面,實驗室最近的研究通過對于剪接體(splicesoeme)的抑制,實現了迄今為止分化潛能最高的人類和小鼠的全能性胚胎幹細胞的捕獲和培養 (Cell, 2021; Cell, 2024)。在此基礎上,我們将進一步對該培養條件進行優化,以期最終獲得不同物種來源的全能性幹細胞的體外培養。繼而全能性幹細胞為起始細胞,探索其分化到不同種類的功能細胞及類器官的分化體系,并進行動物個體的從頭合成和重構,從而最終獲得可應用于再生醫學的高質量細胞和器官。
實驗室也利用基礎的生物化學和分子生物學的手段鑒定和發現新型的RNA調控通路。實驗室最新的研究發現了一種通過基因轉錄起始事件介導的的微小RNA(microRNA)的整體劑量調控機制,以及該機制在早期胚胎發育三胚層命運決定中的關鍵作用 (Nature, 2021)。未來我們繼續緻力于發現和鑒定決定細胞分化命運及腫瘤發生過程中的核心RNA介導的調控通路,并解析其生理學功能。
我們在嘗試利用已知相關知識進行跨物種基因工程應用的相關研究。比如我們最近利用一種植物特異免疫蛋白RDR,實現了對于腫瘤細胞中有缺陷的miRNA的特異編輯和修複,恢複了miRNA對于腫瘤細胞增值的廣譜抑制,開發了腫瘤治療的新方案 (Cell, 2022)。
最後我們也廣泛利用單細胞轉錄組及空間轉錄組等高通量測序技術,解析早期胚胎發育過程及兒童腫瘤發生過程中發育及腫瘤微環境的建立及穩态維持,并試圖找到決定早期胚胎發育及疾病發生過程的決定的關鍵環境因子及事件(Cell Stem Cell, 2022; Cell, 2023a; Cell, 2023b)。
F
G
實驗室圍繞着生命科學的核心内容,主要運用冷凍電鏡技術研究與重大生命過程相關的分子機器的結構和功能,探索重要的基礎生物學機制問題及相關的人類重大疾病的發生機制。近年來,實驗室的科研工作聚焦于核酸-蛋白複合物分子機器及組成複雜的大型蛋白複合物。實驗室的重要研究領域包括:
(1)病原體的核糖體是很多抗菌藥物的天然靶點,同時人源核糖體生物生成(ribosome biogenesis)也在多種人類腫瘤細胞中異常上調,并且和腫瘤轉移的能力正相關。實驗室以細菌、酵母、人源細胞系作為模型,研究人類病原體、模式生物以及人類核糖體的生物組裝機制,不同核糖體結合蛋白在蛋白翻譯中的新穎調控功能和分子機制,以及潛在藥物靶标的發現;
(2)DNA複制是分子生物學的核心環節,DNA複制的紊亂也是衆多腫瘤的一項标志性特征。實驗室研究真核生物DNA複制起始過程的蛋白質分子機器的結構和工作機制。
(3)實驗室同時也和衆多課題組緊密合作,包括臨床科學家,研究人類重大疾病治療靶點的結構和機制。
我們是原位結構生物學實驗室。關注“細胞建築學”:各個亞細胞結構是如何搭建成一個具有完整生物學功能的細胞,以及“生物大分子社會學”:細胞内的細胞器、生物大分子之間的相互關系。
原位結構生物學是基于冷凍光電聯用(CLEM)、冷凍電子斷層掃描(cryo-ET)等技術的新興結構生物學分支,是一種可以在細胞生理狀态下,對生物大分子和亞細胞結構在分子分辨率(1 ~ 10 nm)水平進行原位的結構分析和功能研究的技術手段。我們主要研究方向包括:
H
細胞是生物體的基本單元,每個細胞都是一個複雜而精密的生态系統,在内外環境中都有着精心維護的平衡。細胞内部有着複雜的亞細胞結構,細胞核作為遺傳物質的容器,其染色質環境同樣複雜,包括染色質的多級複雜結構和表觀遺傳信息。而在細胞外部,細胞間的相互作用是生物系統維系的關鍵。雖然以免疫系統和神經系統為研究對象,對細胞之間的信号與功能進行了比較充分的研究,但目前我們所知道的隻是其中的冰山一角。在免疫系統中,存在一類特異性超高的分子──淋巴細胞B和T細胞表面的受體,也即我們熟悉的B細胞受體和T細胞受體,前者的分泌形式即抗體。随着研究技術的快速發展和科學數據的不斷積累,研究的焦點将逐漸從低等模式生物逐漸轉移到人本身,而研究的層次也将更趨于系統性和整體性。我們實驗室将以小鼠和人的免疫細胞為主要研究對象,研究方向集中在:
1. 在哺乳動物複雜的染色質環境下研究DNA複制、DNA損傷和DNA代謝與基因組穩定性和腫瘤發生之間的關系;
2. 在時間和空間尺度上研究衰老過程或不同組織中淋巴細胞功能的變化以及相關的DNA代謝變化;
3. 深入挖掘抗體的發育和成熟機理,并利用合成生物學技術改造細胞,促使其實現抗體生産和抗體進化。
J
主要研究方向:
1、 蛋白質組學新技術新方法-蛋白質高可信度鑒定、定量及翻譯後修飾位點的質譜鑒定
2、 腫瘤細胞表面新生抗原和免疫多肽組的大規模鑒定及其在腫瘤發生、發展與轉移中的作用機制
3、 基于腫瘤細胞表面新生抗原的特異性抗體、抗體藥物偶聯物、免疫多肽組的制備與體内作用機制
4、 神經系統退行性病變相關蛋白與小膠質細胞激活的調控作用機制
主要研究進展:
實驗室主要利用生物質譜技術大規模鑒定與發現重大疾病發生發展相關蛋白及其動态變化,特别關注蛋白質翻譯後修飾(單磷酸化及多磷酸化、乙酰化、甲基化、泛素化、糖基化、組蛋白組合修飾等)對其生物學功能的影響。針對神經系統退行性病變中小膠質細胞激活、Aβ清除與降解、神經元死亡、腫瘤細胞表面新生抗原、免疫細胞和腫瘤微環境相關巨噬細胞表面等發現并鑒定關鍵蛋白及其修飾變化,發現新的關鍵靶标和标志物;結合分子生物學、生物化學、細胞生物學和蛋白質組學技術等多重手段,利用細胞與動物模型和臨床人類标本分析,對腫瘤細胞表面特異蛋白和基因融合蛋白進行體内外功能研究,同時制備特異性抗體、多肽和抗體藥物偶聯物,闡明藥物體内調控機制。此外,我們還開展了蛋白質與抗體藥物等電點、純度、全序列、二硫鍵、糖基化、氧化等修飾的質譜分析研究,建立蛋白藥物相關質量标準。近期主要開展了Cdk5和Sds3調控小膠質細胞激活調控神經系統炎症,以及外泌體臨床檢測新型标志物、結直腸癌和乳腺癌腫瘤細胞表面蛋白新靶标的大規模篩選與功能研究。
研究領域:“感染-免疫-腫瘤”及其相關的細胞信号轉導
識别細胞内DNA的cGAS-STING通路對抗感染和抗腫瘤的免疫監視及治療至關重要。蔣争凡實驗室是發現STING蛋白重要功能的三個實驗室之一(命名為ERIS,PNAS, 2009)及其二聚化(寡聚化)的重要作用,并對其進行了深入系統的研究:發現轉錄因子NFkB和STAT6對該通路介導的免疫反應非常重要(JI, 2017a;Cell, 2011);硫酸化糖胺聚糖是STING活化必需的第二類配體及其高爾基體轉運的原因(Immunity, 2021);ARMH3-PI4KB合成的PI4P驅動STING的内體轉運并維持活化(Immunity, 2023);STING通過形成“相分離器”調節天然免疫(Nature Cell Biology, 2021);Caspases負調控天然免疫反應,包括炎症小體活化的Caspases(Immunity, 2017;JI, 2017b)及凋亡活化的Caspases(Molecular Cell, 2019),避免過度免疫反應并保證細胞凋亡“免疫沉默”;錳離子對于機體抗感染重要(Immunity, 2018;PNAS, 2021),Mn2+是細胞内cGAS的第二個激活劑,以獨特方式激活cGAS(Cell Reports, 2020),以此為基礎發明了可激活細胞免疫、體液免疫和黏膜免疫的錳佐劑(CMI, 2021)及增強腫瘤免疫治療的“錳免療法”(Cell Research, 2020);發現3`3`-cGAMP特異性磷酸二酯酶(Cell Research, 2015)。此外,發現PCBPs-AIP4介導的蛋白質降解途徑負調控天然免疫關鍵分子MAVS降低或避免RNA病毒感染引發的過度反應(Nature Immunology, 2009; Cell Research, 2012)以及NEMO-IKKα/β對于RIG-I-MAVS通路中激活TBK1/IKKε至關重要(PLoS Pathogens, 2017)。
K
L
以昆蟲為傳毒介體的病毒病害一直是造成水稻産量損失最嚴重的病毒病害之一。水稻矮縮病毒 (Rice dwarf virus, RDV) 和水稻條紋葉枯病毒 (Rice stripe virus, RSV)是對我國水稻産生過嚴重産量損失的病毒病害。RDV由葉蟬以持久增殖型方式傳播, RSV由灰飛虱以持久方式傳播,且可經卵傳播。迄今,對病毒如何引起病害研究很多,但是,病毒與介體傳毒昆蟲的相互作用研究的很少。本實驗室主要研究方向:1)病毒與植物宿主的相互作用以及病毒侵染對宿主發育的影響和緻病機制;2)植物宿主對病毒的防禦機制與病毒的反防禦機制;3)病毒與傳播介體昆蟲宿主的相互作用以及介體傳播病毒機制;4)病毒對昆蟲介體免疫系統的幹擾和介體的抗病毒免疫機制。
你是否想要近距離接觸來自海底的神秘智慧生物,觀察它們炫目的變色能力和繁複的觸手運動,運用前沿的神經科學與人工智能技術窺探它們的内心世界?加入我們吧!我們研究頭足類動物(包括烏賊和章魚)的行為與神經。
頭足類動物擁有無脊椎動物中最複雜的神經系統。他們的腦比很多與之體型相當的哺乳動物都還要大(神經元數量比小鼠多一個數量級),也表現出很多複雜的行為和高級的認知功能:如模仿學習,工具使用,有顯著個性等。在演化曆程上,頭足類和我們在6億年前就已經分開了。我們的共同祖先才剛剛演化出神經元,還沒有聚集成可稱之為‘腦’的中樞神經系統。頭足類與脊椎動物各自沿着不同的路徑獨立演化。頭足類神經系統是動物界裡采取和人腦不同的發展路徑所能到達的智力巅峰。研究頭足類另類的智能,既可以發現趨同演化的神經機制,将會揭示在神經計算層面的普遍規律;也可研究人類所不具備的獨特技能背後的神經機制:比如變色僞裝的能力和複雜的觸手運動控制。
(1)烏賊變色僞裝行為的神經機制
烏賊可以改變全身的顔色和圖案來模拟環境并隐藏其中。研究其變色行為有兩個重要意義:一、烏賊的皮膚像一個覆蓋全身的顯示器,通過神經-肌肉系統實時并行控制上百萬個色素細胞的大小來組成不同的圖案,可從該系統中發現控制超高維度的運動輸出的複雜神經算法。二、可以通過烏賊體表圖案的實時變化讀取動物的主觀視知覺和內隐狀态;且由于變色僞裝可以瞞過包括人類在内的捕食者,研究此系統亦可揭示人類視知覺區别物體與背景的原理。研究烏賊控制變色僞裝的神經環路與算法将有助于啟發和革新人工智能的諸多領域。此外,随近年來衛星與無人機偵察技術的發展,軍事單位的迷彩與僞裝也亟需來自動物僞裝策略的仿生學借鑒。
(2)章魚複雜觸手運動的分布式控制
去中心化的系統由大量分布式的控制節點組成,相比于集中式的控制系統,往往能兼具更好的穩定性和更好的靈活性。頭足類神經系統很大程度上是一個去中心化的控制系統,超過2/3的神經元分布于外周,相比之下人類隻有1%的神經元分布于外周。因此,頭足類動物外周神經系統是研究行為分布式控制的獨特對象。
章魚的觸手運動十分複雜,可以用以操縱複雜的工具。它的觸手可以在任意地方朝任意方向彎曲,也可以在任意地方伸長、縮短、變軟、變硬。相比于人類四肢運動的自由度受限與關節的數目,而章魚的觸手幾乎有着無限的自由度。章魚采取一種分布式的方式進行這種超高維度的運動控制,有超過60%的神經元分布于觸手上;在切斷中樞控制之後,觸手自身的神經網絡也能産生協調而複雜的運動。研究章魚觸手運動的分布式控制,将為仿生軟體機器人系統提供獨特的運動控制理論,也将有助于設計出更好的具自适應能力的神經仿生義肢。
神經科學的核心目标是闡明感知、行為和意識等産生的神經機制。
利用果蠅、小鼠和非人靈長類等多種模式動物,我們研究以上過程:1) 視覺“暗光”的分子機制 (Science, 2011; Nature Neuroscience,2008; Current Biology, 2020); 2) 嗅覺編碼機制 (PNAS, 2016; Nature Communications, 2017); 3) 機械感知對進食決策的調控 (Science Advances, 2019); 4) 生物鐘的神經機制 (Nature Communications, 2018; Science Advances, 2022; Nature 2023)。
我們發展了國際前沿的神經電生理技術(包括活體動物腦的多電極膜片鉗記錄),結合分子遺傳、光遺傳和雙光子鈣成像等,揭示大腦産生感知和行為的基本規律。目前,正在進行的研究課題包括:(1) 感覺信号編碼和加工的神經機制;(2) 進食等本能行為的神經機制; (3) 生物鐘和睡眠的神經機制。
基因組多樣性和演化實驗室成立于2009年,以貓科動物基因組學和保護生物學研究為核心,具備分子生物學和生物信息學幹濕實驗綜合實力。實驗室建有生物樣品庫及數據庫管理系統、古DNA超淨平台、基因組數據處理計算服務器等硬件設施;在高通量數據分析、動物基因組組裝與注釋、群體基因學、基因與性狀關聯性分析、連鎖遺傳定位等有豐富的數據分析經驗;且能有效開展分子生物學、生化和細胞水平的功能實驗。
M
S
我們課題組緻力于探索腦發育中細胞命運決定和細胞命運記憶傳承的分子調控機理及相關神經發育疾病的發生與防治。
腦發育中的細胞命運記憶 – 有絲分裂書簽
如何記住?- 有絲分裂書簽TBP維持神經幹細胞命運記憶
細胞的命運和身份主要由其獨特的基因調控網絡決定和維持。細胞命運決定或維持過程出現錯誤均可能導緻疾病發生。然而,有絲分裂卻給細胞命運或身份的跨代繼承帶來了巨大挑戰。細胞在進入有絲分裂後,染色質高度凝集成染色體,絕大多數構成基因調控網絡的元件從染色體上剝離或降解,轉錄活動幾乎完全停滞。随着其獨特基因調控網絡在有絲分裂期的“分崩離析”,細胞好似進入短暫失憶狀态。那麼,細胞在退出有絲分裂進入分裂間期時,是如何精确、及時地重建其獨特的基因調控網絡的呢?關乎細胞命運或身份的“記憶”在有絲分裂期如何被精确儲存,在分裂間期又如何被及時喚醒呢?

我們的最新研究發現在神經發育過程中,轉錄因子TBP通過招募染色質重塑因子EP400增加局部染色質可及性,作為有絲分裂書簽保留在神經幹細胞染色體上,進而維持神經幹細胞的命運記憶。這項研究發現書簽蛋白的有絲分裂保留促進神經幹細胞自我複制和增殖,首次揭示了有絲分裂書簽對神經發育的重要生理學意義,并闡明了書簽蛋白通過調控局部染色質可及性實現染色體保留的新機制。值得一提的是,該研究建立了一個全新的技術方案,實現對發育腦中書簽蛋白在染色體上的保留位點的精确鑒定。這一新方法将助力有絲分裂書簽在其它物種和其它組織器官中的發現及其生理學功能和機制研究的開展。這一研究成果于2024年12月發表于國際知名學術期刊 Molecular Cell。
原文鍊接: http://doi.org/10.1016/j.molcel.2024.11.019
簡介: https://mp.weixin.qq.com/s/VftxDuaIhvym1ybTzn7Hlg

如何遺忘?- 植入染色體的Prospero 轉錄因子凝聚體驅使神經元終末分化
異染色質區域在細胞終末分化過程中如何凝聚和擴展一直以來都是懸而未決的重要科學問題。我們近期的研究發現一個在進化上高度保守的轉錄因子Prospero通過液-液相分離得以植入神經前體細胞有絲分裂染色體的異染色質區域,進而通過促進異染色質區的凝聚和擴展形成轉錄抑制環境,永久沉默自我複制相關基因的表達,最終确保神經元終末分化命運的鎖定。這項研究出乎意料的結果揭示了轉錄因子通過其生物物理特性的變化引起異染色質結構重塑,進而驅動細胞終末分化的新機制。同時,這項研究首次建立了轉錄因子的液-液相變與生理條件下一系列重要生物學事件之間的因果關系,為相分離在動物發育過程中的重要生理學意義提控了強有力的證據。作為亮點推薦文章(featured article) , 這一研究成果于2020年2月發表于國際知名學術期刊 Developmental Cell。雜志同期還配發了評述文章和亮點推薦。
原文鍊接:https://www.cell.com/developmental-cell/pdf/S1534-5807(19)30990-6.pdf
簡介:http:/homes/Index/news_cont/22/14899.html

腦發育中的細胞命運鎖定與疾病發生
神經幹細胞命運及時鎖定 - 信号放大器
幹細胞自我更新與分化間精妙平衡的打破會引起組織穩态失衡,進而導緻發育缺陷和癌症發生。我們的研究發現由神經幹細胞不對稱分裂最初建立的子細胞間的微小差異需要經過一個快速放大的階段才能被最終鎖定為兩個截然不同的子細胞命運,并揭示超級延伸複合物 SEC 通過“信号放大器”機制,驅動這一放大過程快速、精确、穩健地完成。這項研究所揭示的細胞内放大器機制代表了一種細胞自主調控不對稱分裂後子細胞命運鎖定過程精确性與穩健性的普适規律。此外,該研究也為超級延伸複合體的過度激活與多種人類癌症的相關性提供了全新的理論解釋。該研究發現于2017年3月作為封面文章 (cover article) 發表于發育生物學領域頂級期刊Developmental Cell。雜志同期還配發了評述文章和亮點推薦。
原文鍊接:https://www.cell.com/developmental-cell/pdf/S1534-5807(17)30118-1.pdf
簡介:http:/homes/Index/news_cont/22/4151.html

神經祖細胞命運及時鎖定與腦腫瘤發生
我們的研究發現 Retromer 複合體作為“拆彈部隊”将神經祖細胞内可能被“引爆”的 Notch 受體及時“拆除”并運離,從而确保神經祖細胞命運的及時鎖定。該研究揭示的由 Retromer 複合體介導的保護機制可能代表了一種普适規律:通過該機制,潛在有害或有毒的蛋白受體可以被及時清除,從而避免不良的後果。該研究也為解析 Retromer 複合體失活與多種人類癌症相關性的分子機制提供了重要線索。該研究發現于2018年9月發表于eLife 雜志,獲得了同期雜志的特别新聞推送。
原文鍊接:https://elifesciences.org/articles/38181
簡介:http:/homes/Index/news_cont/22/4039.html

T
視覺是高等動物最重要的感知通道,人類獲取的信息80%以上來自視覺。視覺認知神經機制研究對于理解大腦智能的奧秘,構建類腦計算、實現人工智能技術突破,均有重要科學意義。視覺系統的複雜性,源于視覺皮層神經環路的複雜性。由于技術的限制,我們對人類視覺系統環路機制的了解仍然非常有限。
精确到單個神經元的神經環路解析,将能提供腦皮層神經元編碼功能及其相互間的連接和計算關系,這是系統神經科學家長久以來的夢想,也是實現類腦計算、突破人工智能的關鍵和基礎。近幾年,随着在體雙光子成像、光遺傳等新技術湧現,使得這一夢想有可能成為現實,2015年,美國腦計劃斥資1億美元,啟動首個專項腦皮層網絡計劃(MICrONS),使得精細的神經線路繪制成為腦科學競争新的至高點。
我們實驗室建立了首個清醒猴雙光子成像系統,能以單細胞分辨率檢測大量神經元對視覺刺激的反應,分析其視覺信息編碼。該項技術,可以應用在各個不同腦區,包括初級到高級視皮層、前額葉等,以及各種腦認知功能研究,比如客體識别、選擇性注意、工作記憶等的神經機制研究。雙子顯微鏡還可以進行高分辨率的樹突成像,獲得目标神經元在視覺信息處理中的輸入輸出和計算關系。利用樹突成像、光遺傳等新技術,可以獲得單個神經元的局部神經線路,并繪制猕猴視覺皮層的精細神經線路,最終理解腦認知信息處理基本原理,并為類腦計算及新一代人工智能研究提供有突破性的概念和生物學基礎。
主要的研究方向在于運用數學和大規模科學計算的方法去模拟、數值仿真、分析神經生物學中神經元網絡的動力學特性,通過數學分析了解哺乳動物皮層的生物功能是如何在神經元網絡各組分之間的相互作用中産生的。在神經生物學領域中最有意義的貢獻是揭示了神經元網絡動力學和網絡結構之間的可能聯系,而此聯系已有神經生理學上的實驗證據。并且通過模拟哺乳動物視皮層的大規模神經元網絡,利用數學方法找到了一個可能的分岔結構确定了一個視皮層動力學上的運行點,從而發現了哺乳動物視覺朝向選擇性的一個新機制。回國之後,課題組已經 (1) 利用數據時空分解方法研究大規模神經元網絡的動力學性質并進行數據驅動式降維; (2) 應用數學降維方法,開拓分析光學成像數據的技術,發展預測神經元功能網絡和功能連通性(functional connectivity)的算法,(3) 開展同時具有高空間分辨率和高時間分辨率的光學成像技術,研發線蟲行為及其神經環路同步成像的光學成像系統。
W
本實驗室招收對如下課題感興趣的本科生、博士生和博士後(請随時聯系:wsq@pku.edu.cn):
1. 鈣通道和通道型鈣信号蛋白的電生理學
2. 鈣信号轉導相關蛋白的冷凍電鏡結構生物學
3. 細胞局部鈣信号(鈣火花、鈣火星)的時空動态和分子機制
4. 細胞鈣穩态和鈣信号轉導的轉錄調控機制
5. 細胞鈣紊亂及心髒疾病的分子機制和早期幹預對策
6. 自主神經系統對心肌細胞鈣穩态和鈣信号轉導的調控
7. 心髒及其神經支配的發育、再生和類器官模拟
8. 冬眠動物細胞鈣穩态和代謝調控機制及冬眠的人工誘導
Y
實驗室緻力于RNA/DNA修飾的新生物學通路、新功能和新機制研究以及基因編輯新方法的開發。我們綜合運用包括化學生物學、表觀遺傳學、RNA修飾、基因編輯、單細胞組和基因組學等多學科手段,尤其關注RNA生物學在人類疾病診斷與治療當中的應用。

實驗室關注動物的行為,目前,我們最感興趣的是反應時間,抑制控制(如等待),時間感知(如運動計時)和物體識别。以大鼠為行為模式,通過訓練動物執行相關任務來了解這些行為形成和輸出的神經機制,包括對學習過程的了解,以及學習後神經活動與行為的關系。我們用大量的精力通過損傷,化學遺傳學和光遺傳學的方法來幹擾指定腦區,并研究這種操作對動物行為的影響,其中,會通過統計學和機器學習進行詳細姿态分析。為了解神經元在行為中的功能,我們主要采用慢性多通道電生理記錄,同時監測幾十甚至上百個神經元的放電活動,并結合高頻錄像解析神經元與肢體活動的精細關系。長遠看來,通過對腦基本功能的機制解析,實驗室或許能幫助人們進一步理解導緻認知或運動障礙的神經系統疾病,如帕金森氏症,沖動,和多動症。
古代基因組學是利用考古或古生物樣本中獲取的遺傳信息,研究其遺傳背景和種群曆史的技術。本實驗室的研究方向為人和動物的古代基因組學,緻力于探究東亞地區人群遺傳背景的曆史變遷、與歐亞大陸不同地區人群之間的遺傳交流;以及家養動物的起源、擴散、和這些與人類存在密切聯系的動物所反映的人類群體曆史。
Z
以斑馬魚(Danio rerio)為模式動物,開發并完善以CRISPR/Cas為基礎的基因組編輯技術,結合單細胞測序等技術,研究心血管、胰腺等組織器官發育與再生的遺傳基礎及其基因表達調控機制,建立人類疾病的斑馬魚模型并進行發病機制研究。
I. 本實驗室長期以來主要以細胞生物學、分子生物學和生物化學等為研究手段,在分子水平、細胞和亞細胞水平以及組織和個體水平上,從事幹細胞增殖與分化、細胞周期調控、細胞核結構和動态變化及功能、Ran GTP酶功能調控等方面的研究。實驗材料主要包括:培養細胞,小鼠,非洲爪蟾,果蠅等。
II. 已取得如下主要成績:
1,發現Ran GTPase 控制核膜裝配(Science, 2000; Curr Biol, 2011; J Cell Sc, 2012)。10,發現Aurora A/B, Plk1, Cdk1等激酶綜合調控紡錘體裝配(PNAS,2009,2013;Cell Res, 2008, 2011; J Cell Sci, 2009, 2013a, 2013b)。
11,發現CDK1, Aurora A/B和TPX2等綜合調控紡錘體裝配的新機制(J Cell Biol, 2015a; J Cell Sci, 2015;J Biol Chem, 2015)。
12, 發現去泛素化酶Ups16和Plk1綜合調控動粒與紡錘體微管的結合及紡錘體裝配的調控機制(J Cell Biol,2015b;CMLS,2017)。
13,發現細胞周期調控因子調控初級纖毛動态變化及其細胞信号轉導功能(J Cell Sci, 2013, 2014;PLoS Biol, 2015; J Biol Chem, 2017a)。
14,發現DNA複制起始調控因子CDC6調控rDNA轉錄的新機制(J Cell SCI,2016)和調控中心體複制的新機制(NatureCommunications,2017)。
15,發現CDK4-Cyclin D1激酶調控細胞周期起始的新機制(J Biol Chem,2017b)。
III. 在研經費主要來源:科技部幹細胞專項;科技部蛋白質機器專項;基金委重點課題;基金委重大國際合作等。
IV. 熱烈歡迎有志從事相關基礎研究的優秀博士後、博士研究生和本科生加盟。
本實驗室的研究集中在探讨阿爾茨海默病等神經退行性疾病中細胞死亡的機制。我們發現了胞内澱粉樣沉積具有毒性并且在阿爾茨海默病早期引起神經元死亡。另外,我們還發現了一種細胞和細胞之間的稱為納米連接的結構,納米連接可以将細胞聯體并轉運包括澱粉樣沉積在内的胞内物質。納米連接可能在神經退行性疾病中傳遞細胞死亡信号并且造成細胞級聯性死亡。在另一方面,我們發現在阿爾茨海默病的動物中,軸突和軸突起始節部位的可塑性産生改變。在将來的研究中,我們将繼續探讨這種可塑性改變的機制和其對阿爾茨海默病的發生的影響。
張澤民實驗室緻力于用前沿的基因組學和生物信息學技術來解決癌症生物學中的重要問題,利用計算和實驗相結合方法來揭示腫瘤發生過程、腫瘤微環境和對藥物響應中的系統變化和重要遺傳因素,以推進癌症免疫治療和靶向治療的發展。主要的研究方向包括:一,應用單細胞測序技術來研究腫瘤微環境特别是腫瘤浸潤免疫細胞的精确組成、相互作用、以及功能狀态;二,研究腫瘤的異質性、基因組機制、及其對耐藥性的影響;三,開發原創的生物信息學工具和數據庫,來進行單細胞基因組數據和癌症基因組大數據的整合、分析和可視化,以揭示癌症的亞型、驅動基因以及其他緻癌因素的遺傳基礎,從而發現新型癌症靶點和标記物。
主要研究方向包括鑒定影響腫瘤發生發展和轉移調控的新蛋白,揭示泛素化、類泛素化、乙酰化等蛋白質翻譯後修飾在DNA損傷應答、腫瘤細胞耐藥、腫瘤代謝、免疫調控中的作用和分子機制。先後主持和承擔了國家自然科學基金生命學部和醫學部重點項目(3)、面上項目(7),國際合作ICGEB課題(2),教育部博士點優先發展基金、科技部863、973、國家重大科學研究計劃近二十個項目的研究。
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox