檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
CD8+ T細胞的耗竭是抗腫瘤免疫的關鍵阻礙,當前研究集中于腫瘤微環境對CD8+ T細胞的調控,而忽視了CD8+ T細胞自身因素。不同腫瘤的微環境存在巨大差異, CD8+ T細胞無一例外進入耗竭狀态,這暗示除了外在環境因素,尚可能存在驅動CD8+ T細胞耗竭的内在因素。因此,篩選在不同類型的腫瘤中普遍存在的CD8+ T細胞耗竭機制及潛在的驅動因素,可為同時靶向治療不同腫瘤提供可能。
北京時間1月13日,張澤民課題組、李程課題組與清華大學江鵬課題組, 武漢科技大學祝海川課題組合作,在《自然-癌症》(Nature Cancer)期刊以長文的形式發表了題為“ETV7通過促進CD8+ T細胞命運向耗竭的轉化,限制CD8+T細胞抗病毒和抗腫瘤的功能”(ETV7 limits the antiviral and anti-tumor efficacy of CD8+ T cells by diverting their fate towards exhaustion)的研究論文。作者從21種腫瘤病人中篩選到小鼠中缺失而人具有的轉錄因子ETV7,是驅動CD8+ T細胞命運向耗竭轉化的核心,且廣泛存在不同腫瘤中。臨床前免疫治療研究發現,靶向ETV7顯著增強CAR-T細胞的抗實體瘤的治療效果。
為了篩選在臨床病人中廣泛存在的免疫逃逸的關鍵因素,作者使用21種腫瘤病人的單細胞轉錄組數據與ATAC-seq數據進行多組學分析,并通過功能性篩選,鑒定到ETV7為全新促進CD8+T細胞終末分化的轉錄因子。進一步功能研究發現,ETV7的表達通過促進CD8+T細胞的耗竭,抑制其殺傷腫瘤和清除病毒的能力。
機制研究發現,在CD8+ T細胞分化過程中,ETV7作為中心調控因子,逐漸增強與耗竭基因(CTLA4、TOX等七個基因)和記憶基因(TCF7等4個基因)的結合與轉錄調控,通過結合和調控多個經典T細胞耗竭相關基因(CTLA4、TOX等七個基因)和記憶基因(TCF7等4個基因),将CD8+T細胞的命運從記憶轉化為終末耗竭,說明ETV7可能是人CD8+ T細胞耗竭命運決定的中心調控因子(master regulator)。進一步将該研究應用于臨床前實驗中發現,在CAR-T治療實體瘤模型中,敲低ETV7的表達能夠顯著抑制CAR-T細胞耗竭,增強CAR-T殺傷腫瘤的功能,為腫瘤免疫治療提供了新的策略和篩選靶标。
清華大學江鵬團隊博士後程潔(現為華中科技大學同濟醫學院獨立PI)、清華大學2021級研究生肖一峰、北京大學彭婷博士、武漢科技大學張子健博士和華中科技大學秦鈾副教授為本文的共同第一作者。清華大學江鵬副教授為本文通訊作者,武漢科技大學祝海川副教授、北京大學張澤民教授以及李程教授為本文的共同通訊作者。研究得到國家自然科學基金、清華-北大生命科學聯合中心和博士後科學基金的經費支持,以及清華大學動物中心和流式分選平台的大力支持。
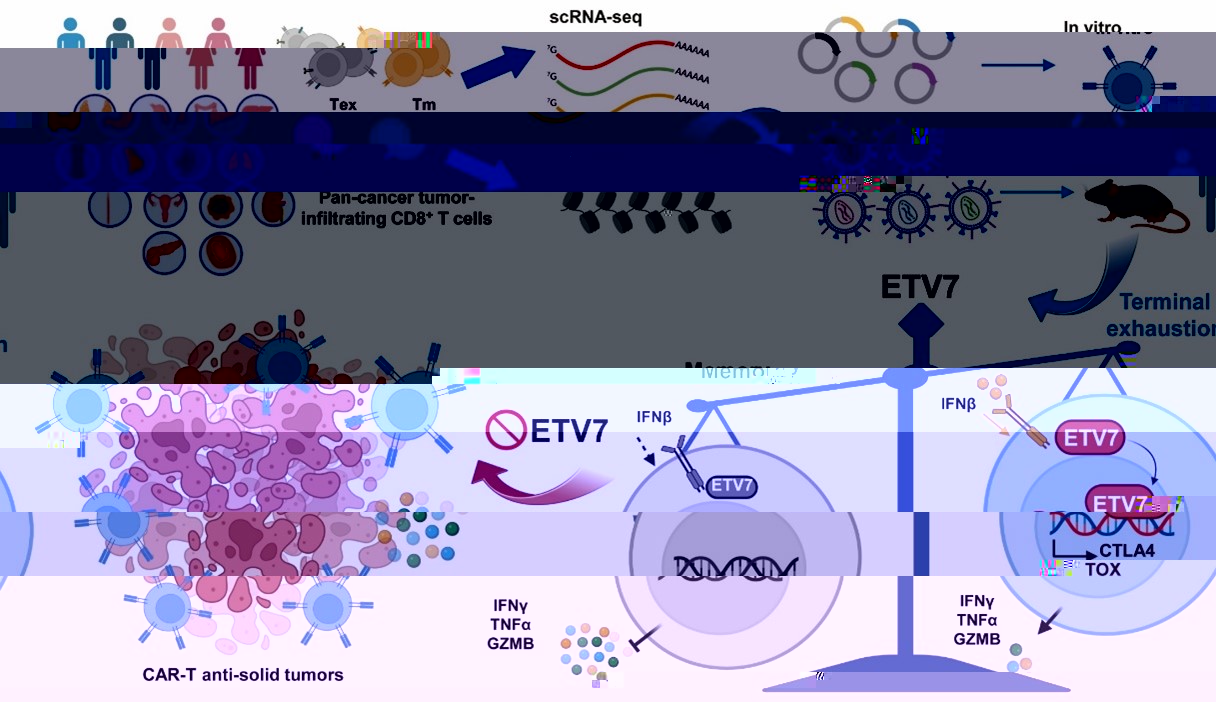
圖1. 腫瘤病人單細胞多組學與篩選鑒定到ETV7作為調控CD8+T細胞命運的轉錄焦點,促進CD8+T細胞的終末分化(耗竭)與功能缺失。靶向ETV7有效增強CAR-T殺傷實體瘤的效率。