檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
植物地上部分來源于莖尖分生組織 (Shoot Apical Meristem, SAM)。KNOX1家族轉錄因子 SHOOT MERISTEMLESS (STM) 維持SAM穩态。盡管與 STM 序列相近的 KNOTTED-LIKE FROM ARABIDOPSIS THALIANA 6 (KNAT6) 等三個KNOX1 轉錄因子表達區域與 STM 高度重合,但對 SAM 維持作用微弱。
2023年9月6日,Molecular Plant 在線發表了beat365官方网站焦雨鈴課題組和中國科學院大學beat365汪穎課題組合作研究論文,題為Condensation of STM is critical for shoot meristem maintenance and salt tolerance in Arabidopsis。團隊之前的研究發現STM自激活促進分生組織維持。在此基礎上,新的研究發現STM不保守的N端具有一段朊病毒樣結構域 (Prion-like Domain, PrD),驅動STM在細胞核内形成蛋白凝集。蛋白凝集能夠增強 STM 的轉錄活性,且鹽處理後凝集增強。與 STM 高度同源的 KNAT6 蛋白不具有蛋白凝集能力。這些發現揭示了STM蛋白功能的特殊性。
研究團隊發現STM在細胞核中形成點狀凝集,信号分布不均勻 (圖1A, 1B),結構分析表明STM結構高度無序的N端具有一個明顯的PrD (圖1C),可以誘導蛋白凝集産生。體外凝集實驗也表明N端可以驅動STM形成蛋白凝集 (圖1D, 1E)。體内蛋白凝集分析發現NaCl可以特異性增強STM蛋白凝集,而抑制蛋白凝集的1,6-己二醇 (1,6-hexanediol顯著抑制STM凝集産生 (圖1F, 1H)。
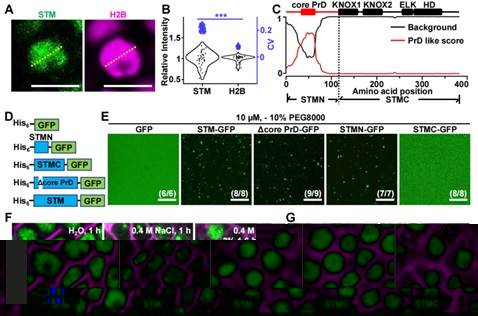
圖1 含PrD結構的N端驅動STM形成蛋白凝集
蛋白凝集形成經常涉及多種大分子互作,本研究發現與 STM蛋白互作的BELL 家族成員在體外和體内形成蛋白凝集,且與STM凝集共定位。此外,該研究還發現中介體 (Mediator) 組分 MED8與STM蛋白互作,MED8 蛋白也具有明顯的PrD結構域并與 STM蛋白形成共定位的凝集。以上發現說明BELL家族成員和中介體均與STM蛋白形成凝集。分子生物學和轉錄組分析表明STM蛋白凝集形成增強轉錄活性,對下遊靶基因的轉錄激活作用顯著增強。研究進一步發現 SAM 的維持依賴于 STM 蛋白凝集的形成。鹽處理能夠增強 STM 蛋白凝集,鹽處理實驗也增強了分生組織活性,導緻更多側芽形成 (圖2)。
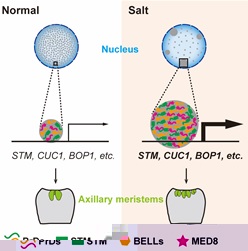
圖2 STM蛋白凝集模型
本研究發現STM在細胞核中形成蛋白凝集,找到了與STM蛋白互作且共同形成凝集的兩類蛋白—BELL和MED8,發現凝集形成能夠增強STM自身轉錄調控活性,是 STM 具有分生組織活性,維持 SAM 的基礎。此外,還發現鹽處理增強 STM 蛋白凝集,使分生組織在高鹽下具有更強的活性。本研究不僅豐富了對STM蛋白作用機制的認識,也将植物分生組織活性和耐鹽性直接聯系在一起,為後續耐鹽植物的培育提供理論基礎。
中國科學院遺傳與發育生物學研究所已出站博士後曹秀衛為論文的第一作者,已畢業研究生杜青偉和郭亞鶴參與了此工作,北京大學生科院焦雨鈴教授和中國科學院大學生科院汪穎副教授為論文的共同通訊作者,該研究得到了國家自然科學基金和中國博士後面上項目資助。
原文鍊接:https://www.cell.com/molecular-plant/fulltext/S1674-2052(23)00257-5