檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
瘧疾仍然是世界範圍内的重要公共衛生問題。據世界衛生組織統計,2020年全球共計約有2.41億人感染瘧疾,造成約62.7萬人死亡 [1]。瘧疾是一種由瘧原蟲感染引起的寄生蟲病,其中惡性瘧原蟲緻死率最高。惡性瘧原蟲以裂殖子形式感染紅細胞并在其中繁殖,最終導緻紅細胞的裂解,從而引起發熱和溶血性貧血等臨床症狀。一些被感染的紅細胞會黏附在胎盤或者大腦的内皮細胞上,引起胎型瘧和腦型瘧等危重症狀。
抗體是人體免疫系統的核心組成部分,對抵禦包括惡性瘧原蟲在内的多種病原體具有重要保護作用。其中,IgM型抗體是人體體液免疫反應的第一道防線,主要以五聚體的形式存在,包含十個抗原結合位點,能夠高效地結合并中和病原體 [2-3]。此外,IgM還能有效的激活經典補體通路,在抵禦瘧疾的過程中發揮重要作用 [4]。北京大學肖俊宇研究組聚焦對IgM分子機制的研究,在之前工作中闡明了IgM五聚體組裝和黏膜轉運的機制、以及IgM被特異性受體識别的機制 [5, 6]。
在與人類長期的“軍備競賽”中,惡性瘧原蟲演化出了拮抗IgM的機制。例如,惡性瘧原蟲會表達一類被稱為PfEMP1的毒力蛋白,并将其分泌至紅細胞表面。這些蛋白分子量為250~350 kDa,有一個很大的胞外區,包含多個達菲樣結構域(Duffy-binding-like domain, DBL),可以結合很多人體分子 [7]。例如,PfEMP1家族的VAR2CSA蛋白能夠結合胎盤表面的硫酸軟骨素,從而将感染的紅細胞滞留于胎盤中的毛細血管,引起胎型瘧 [8]。PfEMP1-TM284VAR1則能夠顯著引起紅細胞的花簇狀聚集(Rosetting),導緻腦型瘧 [9]。定位在惡性瘧原蟲裂殖子表面的DBLMSP蛋白家族成員也能夠招募IgM并利用其逃逸人體的免疫攻擊 [10]。對這些惡性瘧原蟲蛋白與IgM的互作機制之前還沒有得到充分理解。
2023年5月8 日,北京大學肖俊宇課題組在Nature Communications期刊發表了題為“Plasmodium falciparum has evolved multiple mechanisms to hijack human immunoglobulin M”的研究成果,發現惡性瘧原蟲蛋白演化出了多種不同的IgM結合模式,為進一步理解惡性瘧原蟲的免疫逃逸機制提供了重要基礎。
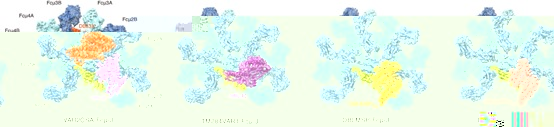
圖1. 四種惡性瘧原蟲蛋白與IgM核心區形成複合體的冷凍電鏡結構。
該研究體外純化了VAR2CSA和TM284VAR1的胞外域,以及DBLMSP和DBLMSP2的DBL結構域,并将它們分别與IgM五聚體的核心區域組裝成複合體,然後利用冷凍電鏡技術解析了這些複合體的結構(圖1)。結果顯示,雖然這些惡性瘧原蟲蛋白均通過其DBL結構域與IgM的中心區結合,但它們與IgM的相互作用存在多種不同模式。VAR2CSA通過DBL3X和DBL5ε兩個結構域同時與三個IgM-Fc(Fcμ)單元結合。DBL3X通過子結構域1(SD1)結合Fcμ2B鍊和Fcμ3B鍊,而DBL5ε則通過SD1與Fcμ1B和Fcμ2B相互作用。另一個PfEMP1蛋白TM284VAR1雖然也含有多個DBL結構域,但隻利用其DBL4ζ結構域與IgM結合。與DBL3X和DBL5ε的結合模式不同,DBL4ζ通過子結構域SD1和SD2介導與Fcμ1B、Fcμ2A和Fcμ2B的相互作用。DBLMSP家族的兩個蛋白DBLMSP和DBLMSP2則通過其DBL結構域中的三個子結構域SD1、SD2和SD3與Fcμ1A、Fcμ1B和Fcμ2B鍊結合,展示了另外兩種不同的結合模式。
那麼,惡性瘧原蟲是如何利用IgM來逃逸人體的免疫系統呢?根據結構研究和生化結果分析,可以将其免疫逃逸機制歸納為以下三個方面:首先,惡性瘧原蟲蛋白與IgM的結合區域是IgM受體分子(pIgR、FcμR等)相互作用的主要熱點區域,因此惡性瘧原蟲蛋白與IgM的結合會幹擾IgM與受體的結合,從而抑制相關的免疫信号通路。其次,IgM會遮蓋許多已知的抗原表位,從而使惡性瘧原蟲蛋白逃逸人體IgG中和抗體的攻擊。此外,由于空間位阻效應,與惡性瘧原蟲蛋白結合的IgM無法再與C1複合體結合、或者無法與抗原發生有效結合,從而阻礙IgM對經典補體途徑的激活(圖2)。
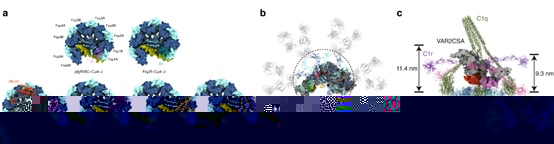
圖2. 惡性瘧原蟲利用IgM介導免疫逃逸。
總之,這一工作厘清了惡性瘧原蟲蛋白與IgM相互作用的複雜分子機制。本應作為人體免疫系統攻擊瘧原蟲有效武器的IgM,反而被惡性瘧原蟲的多個分子以不同方式“劫持”,充當了保護瘧原蟲的“盾牌”(圖3)。

圖3. IgM被惡性瘧原蟲蛋白劫持充當“盾牌”。
蛋白質與植物基因研究國家重點實驗室、beat365官方网站、北大清華生命科學聯合中心肖俊宇研究員為該論文的通訊作者。北京大學博士後紀成功和beat36519級博士生沈皓為該論文的共同第一作者。本研究得到了昌平實驗室、beat365官方网站啟東産業創新基金和北京大學博雅博士後項目的支持。
原文鍊接:https://www.nature.com/articles/s41467-023-38320-z
參考文獻:
1. World malaria report 2021. Geneva: World Health Organization (2021). Licence: CC BY-NC-SA 3.0 IGO.
2. Heyman, B. & Shulman, M. J. in Encyclopedia of Immunobiology (ed Michael J. H. Ratcliffe) 1-14 (Academic Press, 2016).
3. Keyt, B. A., Baliga, R., Sinclair, A. M., Carroll, S. F. & Peterson, M. S. Structure, Function, and Therapeutic Use of IgM Antibodies. Antibodies (Basel) 9, doi:10.3390/antib9040053 (2020).
4. Boyle, M. J. et al. IgM in human immunity to Plasmodium falciparum malaria. Sci Adv 5, eaax4489, doi:10.1126/sciadv.aax4489 (2019).
5. Li, Y. et al. Structural insights into immunoglobulin M. Science 367, 1014-1017, doi:10.1126/science.aaz5425 (2020).
6. Li, Y. et al. Immunoglobulin M perception by FcmuR. Nature 615, 907-912, doi:10.1038/s41586-023-05835-w (2023).
7. Wahlgren, M., Goel, S. & Akhouri, R. R. Variant surface antigens of Plasmodium falciparum and their roles in severe malaria. Nat Rev Microbiol 15, 479-491, doi:10.1038/nrmicro.2017.47 (2017).
8. Fried, M. & Duffy, P. E. Adherence of Plasmodium falciparum to chondroitin sulfate A in the human placenta. Science 272, 1502-1504, doi:10.1126/science.272.5267.1502 (1996).
9. Ghumra, A. et al. Identification of residues in the Cmu4 domain of polymeric IgM essential for interaction with Plasmodium falciparum erythrocyte membrane protein 1 (PfEMP1). J Immunol 181, 1988-2000,doi:10.4049/jimmunol.181.3.1988 (2008).
10. Crosnier, C. et al. Binding of Plasmodium falciparum Merozoite Surface Proteins DBLMSP and DBLMSP2 to Human Immunoglobulin M Is Conserved among Broadly Diverged Sequence Variants. J Biol Chem 291, 14285-14299, doi:10.1074/jbc.M116.722074 (2016).