檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
2023年6月20日,北京大學高甯教授課題組在Cell Discovery上發表了題為“Structural and mechanistic insights into the DNA glycosylase AAG-mediated base excision in nucleosome”的研究論文。論文利用冷凍電鏡技術闡明了DNA糖基化酶(DNA glycosylase)在核小體(Nucleosome core particle,NCP)不同位置上的堿基切除機制。
真核生物的堿基切除修複(Base excision repair,BER)可以定位和修複染色質中的DNA損傷。基因組DNA中含有大量外源損傷劑誘導和自發分解反應造成的DNA堿基損傷。DNA糖基化酶可以識别并切除損傷的DNA堿基,生成一個無嘌呤/無嘧啶的位點(AP site),這個位點可以被核酸内切酶APE1切割并在DNA上産生一個缺口。随後的修複過程可以通過DNA聚合酶、DNA連接酶以及相關蛋白質因子通過兩種途徑修複(Short-patch and long-patch BER pathways)。
烷基腺嘌呤DNA糖基化酶AAG (3-methyladenine DNA glycosylase)可以識别包括3-甲基腺嘌呤(3-methyladenine,3-MA),7-甲基鳥嘌呤(7-methylguanine,m7G),氧化腺嘌呤1,N6-乙醇腺嘌呤(1,N6-ethenoadenine, εA)和脫氨腺嘌呤次黃嘌呤(Hypoxanthine)在内的堿基損傷。在人類中,AAG的表達改變與微衛星不穩定性、自發移碼突變和多種癌症有關。在小鼠模型中,AAG敲除小鼠容易發生肝癌和結腸直腸癌,而在AAG過表達的小鼠中,過度的AAG活性會導緻肝毒性、緻死和其他烷基化誘導毒性。
DNA的堿基損傷可以發生在染色質化的真核生物基因組的所有區域,包括核小體DNA位點。核小體作為天然的屏障會阻礙BER相關蛋白對損傷位點的接觸,隻有一部分面向溶劑側的DNA自由暴露。廣泛的體外研究表明,BER因子可以選擇性地定位并結合到核小體中的不同損傷位點。一般來說,AAG在某一位點的活性和該位點的可接觸性正相關,研究證實與組蛋白核心區域相互接觸的DNA具有更高的突變率,這可能由于BER因子與損傷堿基低的接觸性密不可分。在結構上,損傷堿基的可接觸性取決于其在核小體上的平移位置和旋轉方向,面對溶劑的損傷堿基确實比封閉和嵌入的損傷堿基更容易被修複。以往的結構研究主要聚焦在DNA糖基化酶對于裸露DNA上的修複機制,但這些蛋白質如何克服核小體施加的障礙來定位和修複核小體中的DNA堿基損傷尚不完全清楚。本研究将模拟損傷的堿基(Deoxyinosine, DI)設計在核小體DNA的不同位置上,包括不同的超螺旋(Superhelical locations, SHLs)和旋轉方向上(圖1a),這些位置分别代表了不同的SHLs上相似性的位置(-30,-50)和同一個SHL上不同旋轉方向上導緻的溶劑可及性不同的位置,包括完全暴露(-50),封閉(-53)和嵌入(-55)的位置上。通過冷凍電鏡技術分别解析了四種包含損傷堿基的核小體結構(Apo-state)以及核小體和DNA糖基化酶AAG的複合物結構(Post-catalytic state)。

圖1 AAG-NCP-30AP複合物示意圖
結構分析表明在線性或者核小體DNA底物上,AAG都使用一組同樣的保守氨基酸殘基進行相互作用,并且作用模式比較相似(圖1b-g)。重要的是,通過與不包含DI的NCP結構比較,作者發現僅存在一個DI核苷酸就足以全面擾動核小體DNA的結構,導緻核小體DNA和組蛋白核心之間的包埋表面積減少,并且無論受損堿基的位置如何,這些核小體DNA的整體擾動都處于相似的模式:由DI引起的DNA形變在核小體DNA出口附近最為明顯。
進一步的結構分析發現,在形成的穩定AAG-NCP複合物中(包括-30,-50,-53),NCP的損傷位點都已變成了AP site,處于催化後狀态(post-catalytic state)。在這些AAG-NCPAP複合物中,AAG的結合導緻受損堿基周圍的核小體DNA發生非常顯著但相對局部的扭曲,根據受損部位的平移和旋轉位置,AAG利用不同的機制接觸損傷的堿基。(1)對于具有高溶劑可及性的完全暴露的DNA損傷堿基,AAG具有很高活性,能直接接觸這些損傷堿基,在結構上直接增加DNA的局部扭曲以識别損傷位點(圖2a)。(2)對于具有中等溶劑可及性的封閉的DNA損傷堿基,AAG的活性相比于完全暴露位置的AAG活性低,AAG誘發劇烈的局部的DNA扭曲,并且為了接觸到修複堿基,還需要DNA的旋轉和包含約1 bp的位移去緩解核小體的造成空間障礙(圖2b)。(3)對于溶劑可及性極低的深埋位置的DNA損傷堿基,局部DNA扭曲和有限的核小體DNA位移不足以完全暴露埋藏的堿基。此時,被DI整體擾動的核小體可能更容易自發展開(nucleosome breathing),AAG可以利用這一特性來捕獲分離的末端dsDNA并使這一過程不輕易可逆。因此,在這些完全深埋的位點中,核小體DNA的部分開放可能是AAG的招募和催化的先決條件(圖2c)。
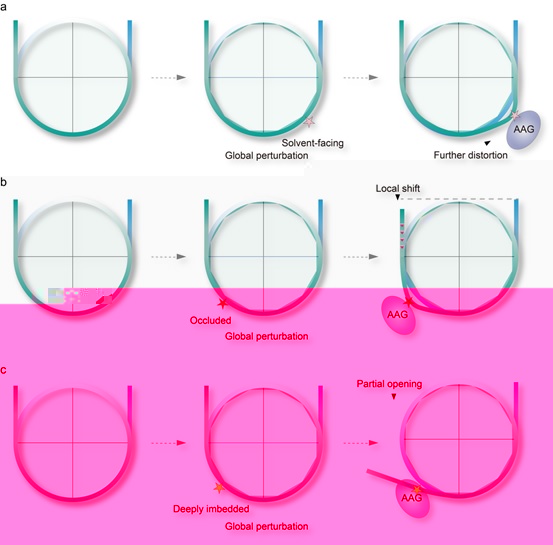
圖2 AAG介導的核小體堿基切除的示意圖
綜上所述,本研究解析了包含不同位置損傷的核小體結構以及核小體和DNA糖基化酶AAG的結構,揭示了堿基損傷對核小體穩定性的影響,為理解DNA糖基化酶AAG如何利用核小體的結構動力學參與核小體中的DNA堿基損傷修複提供了一個機制框架。在更廣泛的背景下,這些數據也有助于理解其它的DNA結合蛋白如何調控核小體的結構動力學來發揮其分子功能。
beat365官方网站高甯教授為本文的通訊作者。高甯實驗室的鄭呂欽(已畢業)和蔡斌(已畢業)為本文的共同第一作者。beat365官方网站的李晴教授提供了本實驗所需的爪蟾組蛋白的質粒。本研究得到了國家重點研發計劃、生命聯合中心、膜生物學國家重點實驗室和beat365官方网站啟東産業創新基金的經費支持,以及冷凍電鏡平台、北京大學電鏡實驗室、高性能計算中心、生科院儀器中心及鳳凰工程的技術支持。
文章鍊接:https://www.nature.com/articles/s41421-023-00560-0